Microbioma e comportamento animale – il caso dell’ansia e della depressione
Recenti scoperte effettuate su modelli animali, seppure in fase embrionale, stanno ponendo ulteriore peso sull’ormai già consolidato ruolo del microbiota intestinale sull’organismo ospite.
Lo sviluppo, il corretto funzionamento del sistema nervoso dell’ospite e il suo comportamento sembrano essere soggetti, attraverso meccanismi ancora da chiarire, all’azione della complessa rete di microorganismi in simbiosi con esso; alterazioni di questo, ancora ipotetico, asse microbiota intestinale – cervello inoltre sembrano correlare con il disturbo depressivo maggiore e i disturbi dello spettro autistico fornendo possibili vie per il trattamento farmacologico.
L’insieme del patrimonio genetico e delle interazioni ambientali della totalità dei microorganismi (microbiota) che vive in simbiosi con un organismo (ospite) è definito microbioma.
Queste popolazioni, costituite da batteri, virus, funghi, archea e protisti, per un totale di 1000 specie ad oggi identificate, vivono a stretto contatto con i tessuti epiteliali dell’ospite (tratto gastrointestinale, cavo orale, tratto genitourinario, pelle, solo per fare qualche esempio nell’uomo) e sono modulate da un delicato equilibrio tra fattori genetici e fattori ambientali (dieta, infezioni, stress, trattamenti farmacologici).
Già dagli anni ’50 con il genetista e microbiologo Joshua Lederberg (Nobel nel 1958) alla complessità funzionale di queste comunità ecologiche (in particolare quella intestinale) fu dato risalto: metabolismo, immunità e sostegno alla funzione gastrointestinale rappresentano i punti salienti di questo ancestrale rapporto simbiotico tra uomo e microbiota intestinale.
Ma sembra esserci dell’altro: perturbazioni del microbiota intestinale (disbiosi), analizzate su modelli animali (da laboratorio e selvatici), sono state associate a cambiamenti nel comportamento sociale e nella comunicazione (tra i quali rientrano poi i disturbi dello spettro autistico o ASD), alterazioni nella risposta allo stress (Ansia e Disturbo Depressive Maggiore o MDD) e sorprendentemente alterazioni in facoltà cognitive come apprendimento e memoria.
Il cervello si e sviluppato in modo da integrare efficacemente multiple e complesse informazioni sensoriali generando delle risposte in linea con le necessita dell’individuo e le sue esperienze. Come risposta a bisogni fisiologici o cambiamenti ambientali gli animali, nel corso dell’evoluzione, hanno sviluppato meccanismi che permettono di plasmare il loro comportamento.
Sulla base di precedenti studi su modelli murini i quali suggerivano che l’esposizione ad agenti stressogeni fisici e psicosociali modificasse il profilo del microbiota intestinale ci si è chiesti se questo, a sua volta, influenzasse comportamenti correlati allo stress come la risposta combatti o fuggi, la ridotta esplorazione, il “congelamento” o la tigmotassi (cambiamento della direzione di movimento di un organismo a seguito di uno stimolo meccanico, generalmente tattile).
A tal scopo è stato adattato il classico esperimento di valutazione dell’efficacia di ansiolitici su modello murino: i livelli di ansia dell’animale, per natura avverso agli spazi aperti e tigmotattico, sono misurati quantificando il tempo speso da questo negli spazi coperti del labirinto a croce elevato.
Valutando pertanto il comportamento esplorativo e la prevenzione del rischio dell’animale si e osservato come topi GF (germ-free, privi di microorganismi commensali intestinali), rispetto a topi SPF (specific-pathogen free), in condizioni basali, abbiano una più alta motivazione esplorativa mentre, in risposta ad un agente stressogeno, subiscano una maggiore diminuzione della stessa con un aumento correlato dei livelli plasmatici di ormone adrenocorticotropo e corticosterone (ormoni dello stress); insomma l’assenza dell’influenza microbiotica sembra essere legata ad una marcata inibizione del comportamento esplorativo in risposta allo stress, una sorta di iper-responsività ansiosa a quest’ultimo.
Esperimenti anologhi su GF zebrafish (specie animale da poco utilizzata come modello in laboratorio) e su topi esposti ad antibiotici (che hanno azione deleteria sui microorganismi intestinale) hanno mostrato risultati concordanti.
A questo si aggiunge l’ipotesi che il presunto ruolo neurofisiologico del microbiota possa essere preponderante in una data finestra temporale (molto probabilmente coincidente con lo sviluppo dell’animale). In topi GF, l’effetto della convenzionalizzazione con microbiota di topi SPF è maggiore alle sesta settimana piuttosto che alla quattordicesima. In linea con questa ipotesi infine vi e l’osservazione che alterazione del microbiota vaginale materno, in risposta allo stress, possa influire sul comportamento della prole.
E l’uomo?
Uno studio clinico randomizzato su uomini sani suggerisce che possa sussistere una correlazione tra trattamento con probiotici (L. Helveticus e Bifidobacterium Longum) e una diminuzione degli indici di ansia nel test auto-valutativo Hospital Anxiety and Depression Scale.
Parallelamente la valutazione dell’impotenza (incapacità di fare) e dell’anedonia (incapacità di provare piacere) tramite la misurazione del tempo di immobilizzazione in test da nuoto forzato o da coda-sospensione ha permesso di stabilire una relazione tra alterazioni del microbiota intestinale e manifestazioni comportamentali di natura depressiva.
Nei test suddetti, alcuni esperimenti hanno osservato un ridotto tempo di immobilizzazione in topi GF, rispetto ai topi SPF, tipico segno di accertamento dell’efficacia di un farmaco antidepressivo.
Nell’uomo invece il trattamento con probiotici sembra, come nel precedente esperimento, migliorare indici emozionali e ridurre ruminazione (pensiero depressivo) e aggressività. Inoltre il profilo del microbiota fecale di pazienti con DDM sono sostanzialmente alterati rispetto ai controlli sani, in particolare nei livelli di Actinbacteria e Bacterioidetes.
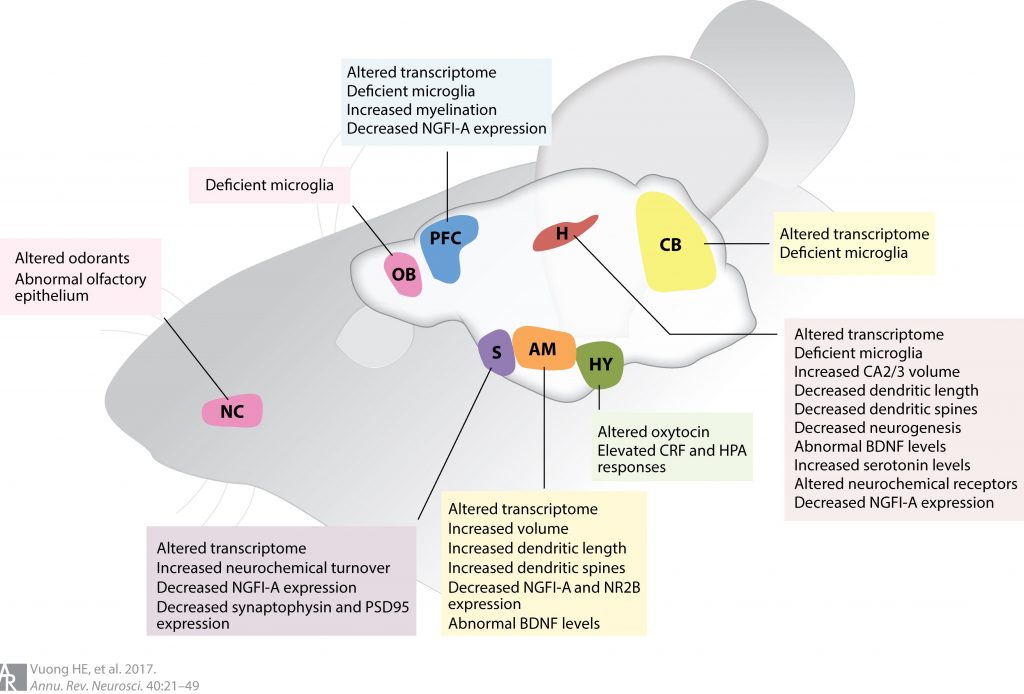
Rimane però ancora da chiarire come alterazioni del microbiota intestinale possano, nei casi descritti, portare a variazioni metaboliche in specifiche regioni del cervello animale. Numerose vie possono risultare implicate (innervazione vagale, signaling neuro-endrocrino e regolazione neuro-immune) e alterazioni nei livelli trascrizionali di particolari geni coinvolti nel metabolismo degli steroidi, nel potenziale sinaptico a lungo termine o nel signaling del cAMP, cosi come variazioni morfologiche a livello dendritico e alterazione delle mielinizzazione sono state già osservate.
Le aree del cervello implicate corrisponderebbero a stazioni importanti per i dinamici circuiti nervosi correlati a stati emozionali quali ansia, paura, depressione e stress (amigdala, ippotalamo, corteccia prefrontale).
Le domande su come e se direttamente il microbiota regoli la neurofisiologia e sia implicato nella patogenesi di disordini neuro-comportamentali sono innumerevoli e la strada per analisi di queste interazioni nell’essere umano e quindi per un approccio di tipo farmacologico è ancora lunga.
In ogni caso quella che sembra erompere con vigore è la figura di esseri viventi intesi come olobionti, come unita primarie (animale + microbi) soggette, in quanto tali, alla pressione evolutiva; ciò non è altro che l’ennesima dimostrazione del delicato intreccio di interazioni di una Natura che non smette di sorprenderci e di dimostrare la sua complessità.
Piervito Lopriore
Bibliografia
Helen E. Vuong, Jessica M. Yano, Thomas C. Fung and Elaine Y. Hsiao (2017) The Microbiome and Host Behavior. Annu. Rev. Neuroscience
